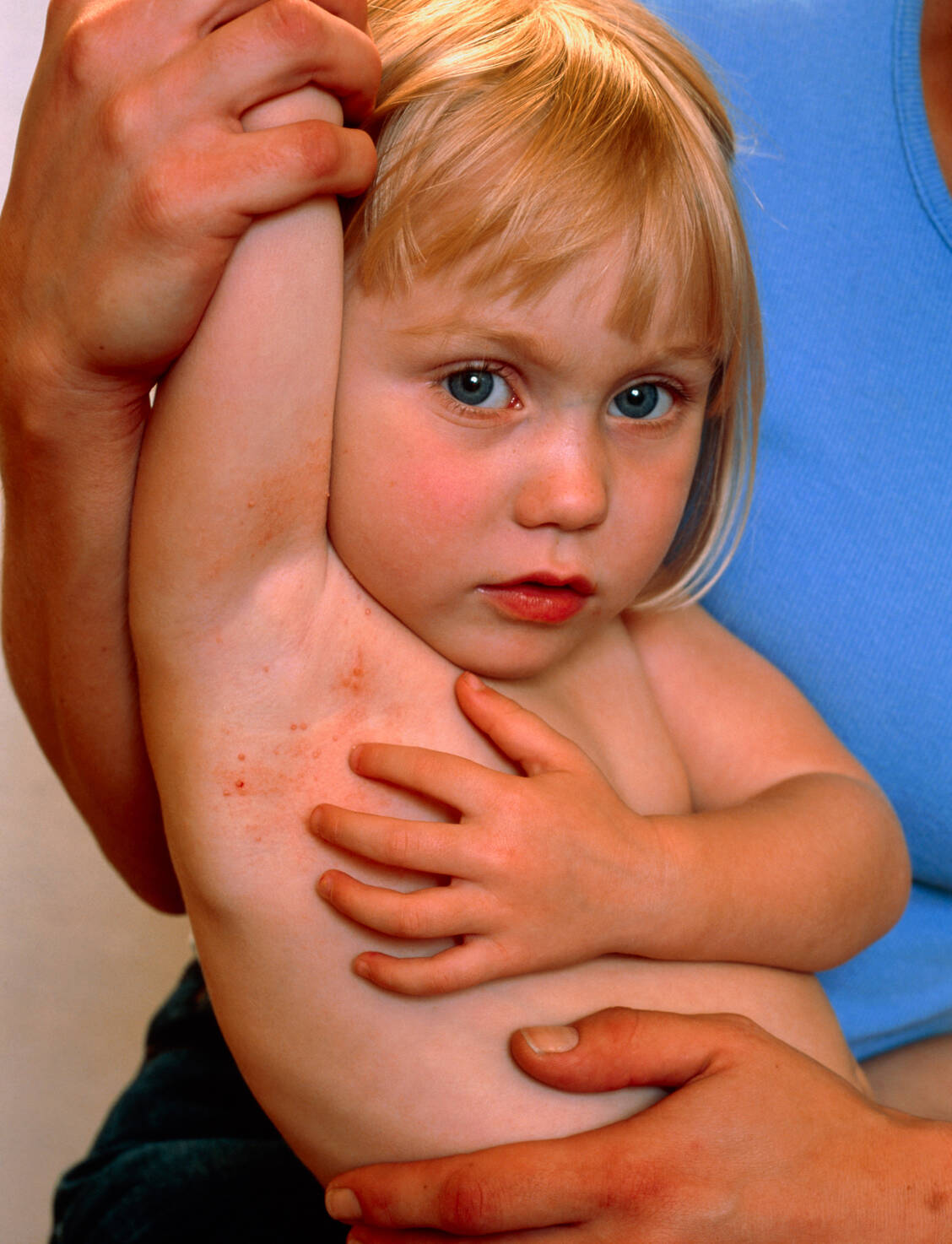
MC ist nach Monaten zwar selbstlimitierend, aber hochansteckend. Auf eine spontane Abheilung kann meist nicht gewartet werden. Zudem sind überwiegend kleine Kinder von den Mollusken betroffen. Derzeitige Behandlungsmethoden sind in Deutschland meist physikalischer Natur (Kryotherapie, Laser und Kürettage). Darüber hinaus steht einzig 5-prozentige Kalilauge als Medizinprodukt zur Verfügung. Wirksame Optionen, die diese therapeutische Lücke füllen, werden dringend benötigt.
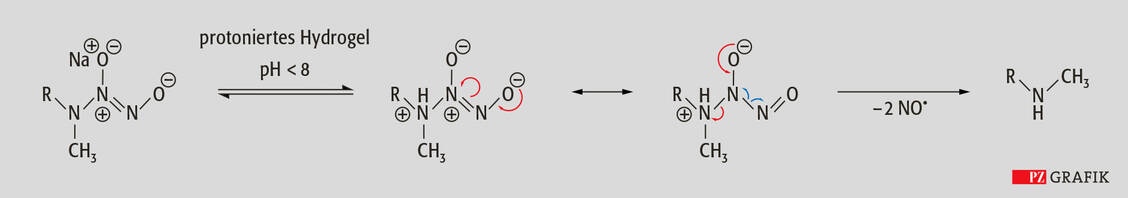
Berdazimer ist ein Polysiloxan, das in der Seitenkette eine sogenannte NONOat-Gruppe (2-Hydroxy-2-nitrosohydrazin oder Diazeniumdiolat) trägt. Das besondere Merkmal des Berdazimer-Gels ist die ausgeklügelte Formulierung für die topische Applikation. Das NONOat-Polymer ist in ein protisches Hydrogel eingebettet, um so den pH-Wert abzusenken und in einem langsamen, kontrollierten Prozess die NONOat-Gruppe zu protonieren. Im sauren Milieu ist diese nämlich instabil und setzt zwei Moleküle NO frei (Abbildung).