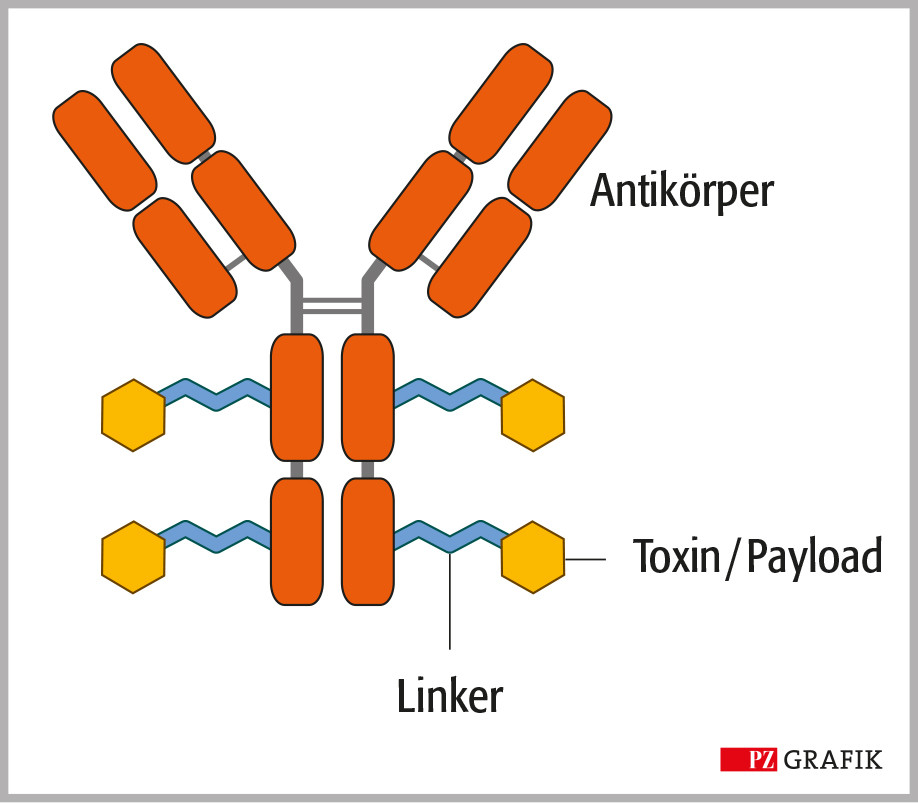
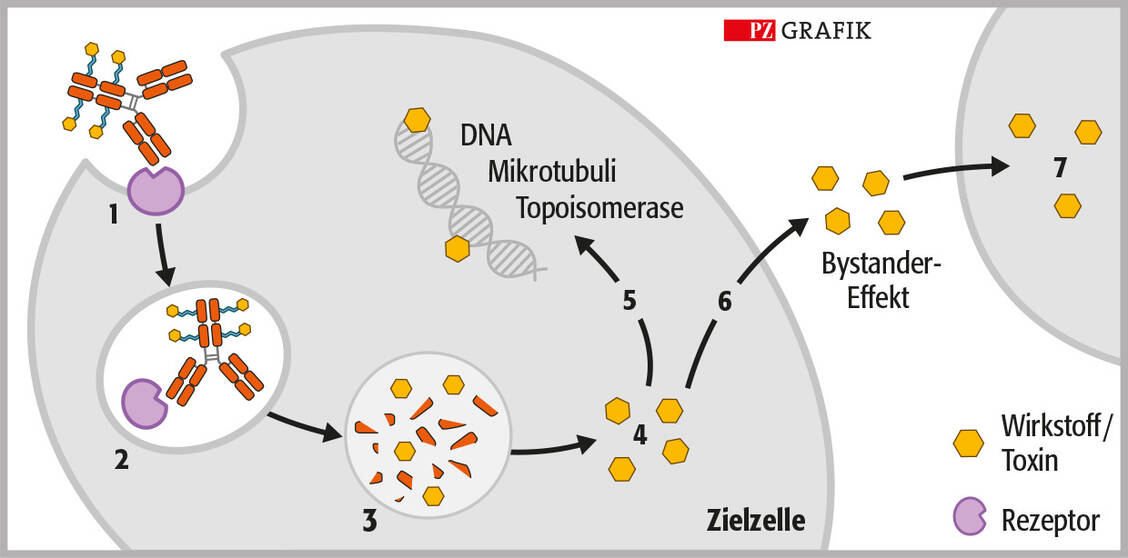
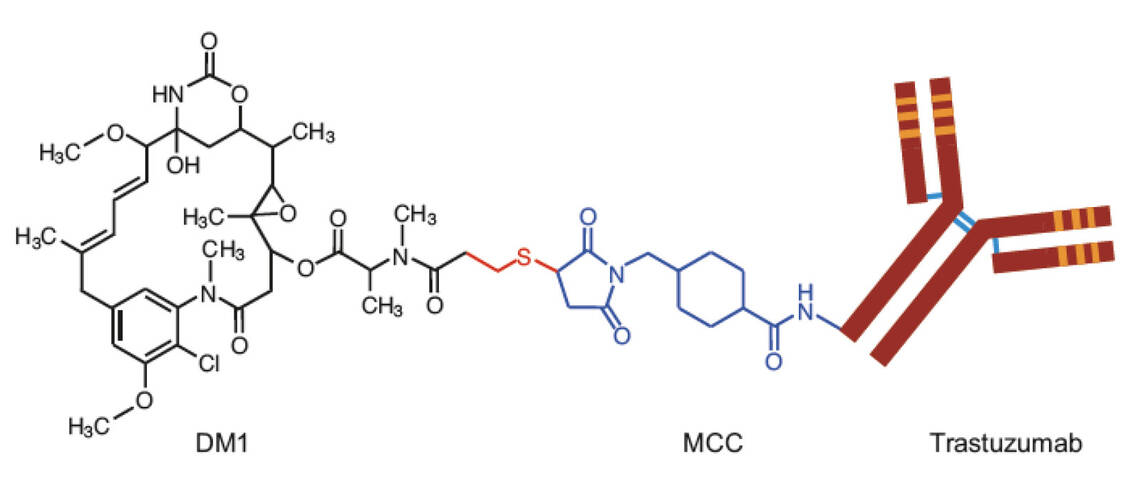
Chari, R. V. J., et al., Antiköper-Wirkstoff-Konjugate: ein neues Konzept in der Krebstherapie. Angew Chemie, 2014; DOI: 10.1002/ange.201307628
Duerr, C., Friess, W., Antibody-drug conjugates – stability and formulation. Eur J Pharm Biopharm, 2019; DOI: 10.1016/j.ejpb.2019.03.021
Dumontet, C., et al., Antibody-drug conjugates come of age in oncology. Nat Rev Drug Discovery, 2023; DOI: 10.1038/s41573-023-00709-2
Fachinformationen der genannten Präparate
Flynn, P., The antibody-drug conjugate landscape. Nat Rev Drug Discovery, 2024; DOI: 10.1038/d41573-024-00064-w
Garcia-Alonso, S., et al., Resistance to Antibody-Drug Conjugates. Cancer Research 2018; DOI: 10.1158/0008-5472.CAN-17-3671
Kostova, V., et al., The Chemistry behind ADCs. Pharmaceuticals, 2021; DOI: 10.3390/ph14050442
Ludwig, W. D., Arzneiverordnungsreport 2023
Phuna, Z. X., et al., Antibody-drug conjugates: Prinicples and opportunities. Life Sciences, 2024; DOI: 10.1016/j.lfs.2024.122676
Senior, M., Cancer-targeting antibody-drug conjugates drive dealmaking frenzy. Nat Biotechnol 2024; DOI: 10.1038/s41587-024-02168-5
Tsuchikama, K., An, Z., Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell, 2018; DOI: 10.1007/s13238-016-0323-0
Tsuchikama, K., et al., Exploring the next generation of antibody-drug conjugates, Nat Rev Clin Oncol, 2024; DOI: 10.1038/s41571-023-00850-2