.
Chronische Wunden
von Gudrun Heyn, BerlinModernes Wundmanagement ist heute weit mehr als
nur das einfache Verbinden einer Verletzung. Milieu- und stadiengerecht
wird die Versorgung dem Heilungsprozess angepasst. Dabei werden moderne Wundtherapeutika auch nach lange bekannten Prinzipien eingesetzt, deren
Wirkungsweise aber erst heute verstanden wird.
Weltweit leiden etwa zwei Prozent der Bevölkerung an chronischen Wunden
(1). Dies sind Wunden, die zwei bis drei Wochen nach der Gewebeschädigung
immer noch nicht abgeheilt (epithelisiert) sind. Extrem große und tiefe
Verletzungen benötigen in der Regel etwas mehr Zeit und die Definition
wird weniger streng gehandhabt. Von einer Therapieresistenz sprechen die
Experten, wenn eine Wunde trotz kausaler und sachgerechter lokaler
Behandlung innerhalb von drei Monaten nicht zu heilen beginnt oder nach
zwölf Monaten nicht abgeheilt ist.
»Wesentlich rascher stellt sich ein Heilungserfolg ein, wenn chronische
Wunden entsprechend den Stadien des Heilungsprozesses lokal behandelt
werden«, sagte kürzlich der Oberarzt und Leiter des Fortbildungskurses
»Pflegeexperte Wundmanager«, Dr. Andreas Fischer, von der Charité während
der Veranstaltung am Evangelischen Geriatriezentrum in Berlin (EGZB) (14).
Vor allem das Prinzip der feuchten Wundversorgung wurde nach langen Jahren
wiederentdeckt. Doch während die Lokaltherapie allgemeinen Regeln folgt,
muss die Ursache jeder Wundheilungsstörung individuell behandelt werden.
Ursachen chronischer Wunden
Bei alten, kranken oder mangelernährten Menschen reichen oft schon
kleinste Verletzungen aus, um eine schwer heilende Wunde hervorzurufen.
Wenn der Defekt so groß ist, dass Gewebe aufgefüllt werden muss, oder an
einer Stelle liegt, die ständiger Reibung oder Nässe ausgesetzt ist, kann
die Heilung zusätzlich verzögert oder verhindert werden. Aber auch
Medikamente wie Immunsuppressiva und Zytostatika können eine
Wundheilungsstörung hervorrufen.
In Deutschland zählen Ulcus cruris (Unterschenkelgeschwür, offenes
Bein), Dekubitus (Druckgeschwür) und diabetisches Fußsyndrom zu den
häufigsten schwer heilenden Verletzungen der Haut. Etwa vier Millionen
Menschen sind betroffen. Unterschenkelgeschwüre entstehen zum größten Teil durch eine
chronisch-venöse Insuffizienz infolge einer Venenerkrankung (2). Das Blut
kann nicht mehr effizient zum Herzen zurücktransportiert werden und die
Beinvenen werden durch den Druck und das Volumen übermäßig belastet. An
hämodynamisch besonders ungünstigen Stellen wie den Innenknöcheln sind
dann oft die Makro- und die Mikrozirkulation des Blutes gestört. Häufig
zeigen Hautverfärbungen die Mangelversorgung an. Etwa ein Prozent der
Patienten, vor allem ältere Menschen, entwickeln daraus ein Ulcus cruris
venosum.
Da die Patienten keine generelle Wundheilungsstörung haben, sondern
eine auf den Unterschenkel begrenzte Heilungsbehinderung, soll eine
kausale Therapie den ungehinderten Blutfluss wieder ermöglichen und die
Druck- und Volumenüberlastung reduzieren. Neben der operativen Behandlung
ist vor allem die Kompressionstherapie Mittel der Wahl. Wechsel- und
Dauerverbände sowie zwei zugelastische medizinische Kompressionsstrümpfe
und -strumpfhosen können verwendet werden (2). Mit Druckpolstern lässt
sich die Wirkung noch verstärken.
Vorsicht ist geboten, wenn das Ulcus cruris seine Hauptursache in einer
arteriellen Durchblutungsstörung (Knöchelarterienverschlussdruck unter 80
mmHg) hat. Die Kompression würde die bestehende Mangelversorgung des
Gewebes mit Sauerstoff noch weiter unterbinden und ist daher beim Ulcus
cruris arteriosum kontraindiziert.
Arterielle Durchblutungsstörungen durch eine periphere arterielle
Verschlusskrankheit (pAVK) sind etwa für ein Drittel der
Unterschenkelgeschwüre verantwortlich. Auslöser sind kleine Verletzungen
in den Arterien. Über Entzündungsreaktionen, Proliferation von Zellen
sowie Einlagerung von Cholesterol und Triglyzeriden bilden sich Plaques,
die das Gefäßvolumen einengen und den Blutstrom behindern. Eine
Geschwürbildung kündigt sich meist durch kalte Haut, Verfärbungen oder
eine Pilzinfektion an. Die kausale Therapie des Ulcus cruris arteriosum
zielt darauf ab, die Durchblutung zu verbessern. Dies kann operativ
geschehen oder/und durch Arzneimittel wie Acetylsalicylsäure oder
Phenprocoumon.
Obwohl das Ulcus cruris arteriosum bei Menschen mit Diabetes fünfmal
häufiger vorkommt als beim Nichtdiabetiker, stellt für diese Patienten das
diabetische Fußsyndrom die schwerste Komplikation dar. Etwa 34.000
Gliedmaßen werden jedes Jahr in Deutschland amputiert (3). Als
Hauptursache der chronischen Fußgeschwüre gilt die Neuropathie, eine
häufige Spätfolge des Diabetes mellitus (4). Durch die Nervenschädigung
nehmen die Patienten Schmerz, Druck, Temperatur und Vibrationen immer
weniger wahr. Aus kleinen Verletzungen können sich unbemerkt große,
infizierte Wunden entwickeln. Zur kausalen Therapie gehören daher neben
der optimalen Einstellung des Stoffwechsels richtiges, orthopädisches
Schuhwerk und die Schulung der Patienten.
Druckgeschwüre durch anhaltenden äußeren Druck können am ganzen Körper
entstehen. Nach vorsichtigen Schätzungen in der
Gesundheitsberichterstattung des Bundes entwickeln jährlich mehr als
400.000 Personen in Deutschland, vor allem immobile, kranke und ältere
Menschen ein behandlungsbedürftiges Druckgeschwür (Dekubitus) (6). Dabei
gehen die Experten davon aus, dass etwa 10 Prozent der Patienten in
Krankenhäusern, 20 Prozent der zu Hause gepflegten Menschen und 30 Prozent
der Pflegebedürftigen in geriatrischen Kliniken und Altenheimen unter
einem Dekubitus leiden. Obwohl dieser in der Regel nur als untergeordneter
Nebenbefund in medizinisch-pflegerischen Aufzeichnungen erwähnt wird, ist
er eine eigenständige Erkrankung, die zum Tod führen kann (6). Erste
Anzeichen sind Rötungen der Haut, die sich nicht mehr wegdrücken lassen.
Bei der Therapie gilt es vor allem, durch eine häufig wechselnde
Lagerung des Patienten eine Druckentlastung herbeizuführen. Wenn möglich,
soll er mobilisiert werden. Damit keine Wunde entsteht, ist eine gute
Hautpflege wichtig. Trockene und spröde Haut sollte mit
Wasser-in-Öl-Emulsionen gepflegt werden. Permanenter Feuchtigkeit kann man
mit Inkontinenzprodukten begegnen.
Stadien der Wundheilung
Unabhängig von der Ursache einer Wunde verläuft der Heilungsprozess
immer gleich. Nacheinander, aber auch überlappend werden eine Reinigungs-
(Entzündungsphase, Inflammation), Granulations- (Proliferation) und
Epithelisierungsphase durchlaufen. Gemeinsames Merkmal ist, dass
unterschiedliche Zelltypen miteinander interagieren, aktiviert werden und
proliferieren (5).
Im optimalen Fall ist die Reinigungsphase recht kurz (Abbildung 1). Als
Erstes wird die Blutung durch die Gerinnungskaskade gestoppt. Es bilden
sich Gerinnsel aus Fibrinmolekülen, Fibronectin, Vitronectin und
Thrombospondin. Sie dienen als Leitstruktur für einwandernde Zellen (1).
Gleichzeitig schütten die Thrombozyten im Gerinnsel Wachstumsfaktoren und
Zytokine aus und locken damit immunkompetente Zellen an den Ort der
Gewebeverletzung. Es kommt zu einer lokalen Entzündung, bei der
neutrophile Granulozyten eingedrungene Erreger abwehren. Außerdem wird
abgestorbenes Zellmaterial durch hoch potente Proteasen beseitigt. In
dieser Phase werden meist große Exsudatmengen abgegeben, die die
Selbstreinigung der Wunde unterstützen.

Abbildung 1:
Reinigungs- und Entzündungsphase der Wundheilung.
Links: Ist eine
Wunde entstanden, setzt zunächst die Blutgerinnung ein. Thrombozyten
bleiben an den Wundrändern an kollagenen Bindegewebsfasern hängen und das
Gerinnungssystem wird aktiviert. Am Ende dieses Prozesses füllt eine
provisorische Matrix aus Fibrinfasern die Wunde aus.
Rechts: Anschließend wandern Monozyten und Granulozyten in das
Wundgebiet ein. Sie reinigen die Wunde von Zelltrümmern und Geweberesten
und sorgen für die Infektabwehr.
Ausgehend von den Wundrändern wandern in der Granulationsphase
Monozyten, Endothelzellen und Fibroblasten entlang der provisorischen
Fibrinmatrix in das Wundareal ein (Abbildung 2). An den Rändern des frühen
Granulationsgewebes bauen Zellen nekrotisches Gewebe ab und beginnen am
Übergang zum Normalgewebe mit der Neusynthese einer extrazellulären Matrix
(5). Nach einigen Tagen nimmt die Zellzahl in dieser Matrix massiv zu.
Bindegewebe und Blutgefäße werden sichtbar. Auch neues Kollagen wird
synthetisiert.
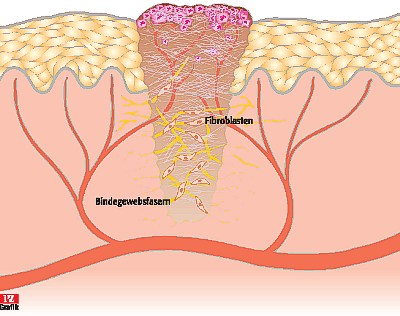
Abbildung 2:
Granulationsphase
Während der zweiten Phase
werden neue Gefäße gebildet. Außerdem wandern Fibroblasten in die
Wundregion ein und bilden extrazelluläre Matrix aus amorpher Grundsubstanz
und Kollagenfasern.
Ist die Wunde ausreichend ausgefüllt, überziehen Epithelzellen das noch
unfertige Bindegewebe (Abbildung 3). Diese wandernde Zellschicht ist hoch
empfindlich gegenüber Scherkräften und kann bei einem Verbandwechsel
leicht reißen. Ausgehend vom intakten Epithelgewebe an den Wundrändern
bildet sich die neue Epidermis und die Wundheilung gilt als abgeschlossen.
Nach der Phase der Epithelisierung können sich die Umbauprozesse im Gewebe
noch bis zu einem Jahr hinziehen.

Abbildung 3:
Epithelisierungsphase
Myofibroblasten sorgen für
eine Kontraktion der Wundränder. Keratinozyten vom Wundrand und den
Haarwurzelscheiden bilden ein neues Epithel.
Die moderne Lokaltherapie einer chronischen Wunde ist komplex.
Faktoren wie Nekrosen, Infektionen, mangelnde Nährstoffversorgung der
Wunde, gestörtes Flüssigkeitsgleichgewicht, Überschuss an Proteasen und
Mangel an Wachstumsfaktoren müssen berücksichtigt werden. Ziel ist es, die
chronische Wunde wieder in eine aktive Wunde mit physiologischem
Heilungsverlauf zurückzuführen (7).
Wundreinigung und Débridement
Die phasenorientierte Behandlung einer chronischen Wunde beginnt mit
der Reinigung. Nicht haftende Beläge und Sekret werden mit einer
Wundspülung entfernt. Hierzu eignen sich antiseptische Lösungen wie
Polihexanid, Taurolidin oder Octenidin. »Es ist aber auch durchaus
möglich, eine chronische Wunde mit einem sanften Wasserstrahl unter der
Dusche zu säubern«, hieß es bei dem Wundmanagerseminar im EGZB.
In erster Linie müssen trockene, schwarze Nekrosen beseitigt werden, da
sich darunter anaerobe Keime in die Tiefe ausbreiten können. Außerdem
stellen sie einen guten Nährboden für Bakterien dar. Auch zähe
Fibrinbeläge sollten abgetragen werden, da sie die Granulation hemmen.
»Rosig und feucht soll eine gereinigte Wunde aussehen«, sagte Fischer.
Débridement wird die Entfernung nicht vitalen Gewebes aus der Wunde
genannt. Da dabei Makrophagen, Endothelzellen und Fibroblasten rekrutiert
sowie Wachstumsfaktoren und Zytokine am Wundgrund freigesetzt werden,
wirkt sich das Débridement günstig auf die Wundheilung aus (8).
Verschiedene Methoden stehen zur Verfügung. Die Tiefenausdehnung des
abgestorbenen Gewebes, die Menge an Wundflüssigkeit, Größe und
Lokalisation der Wunde sowie der Zustand des Patienten bestimmen das
geeignete Verfahren.
Mittel der Wahl für feste, zähe Beläge ist das chirurgische Débridement.
Dabei werden Wundgrund und -ränder mit Skalpell, Kürette oder scharfem
Löffel gesäubert. Je glatter die Wundränder sind und je näher sie
beieinander liegen, desto besser verheilt die Wunde. In der Regel erfolgt
das Débridement unter Lokalanästhesie, etwa mit einer Creme mit Lidocain
und Prilocain, oder mit subkutaner Infiltrationsanästhesie. Bei großen
Wunden kann eine Allgemeinnarkose notwendig sein.
Für Patienten, denen das scharfe Débridement zu schmerzhaft ist, gibt
es eine biologische Alternative: Fliegenlarven wie Lucilia sericata. Heute
werden sie steril gezüchtet und sind als Rezepturarzneimittel zugelassen.
Die Maden werden lose als so genannte Freiläufer oder eingeschweißt in
Beuteln (Biobags) in der Wunde eingesetzt. Ein feinmaschiges Netz über der
Wunde verhindert ein Entkommen der losen Larven. Abschließend werden Netz
oder Biobag mit einem Verband fixiert, der auch größere Flüssigkeitsmengen
aufnehmen kann. Nach etwa vier Tagen werden die tierischen Therapeuten
entfernt.
Während die Biobags einen eindeutigen psychologischen Vorteil haben,
gehört die Therapie mit Freiläufern zu den besten Methoden, um verwinkelte
und tiefe Wundhöhlen zu erreichen. Relativ rasch und atraumatisch
beseitigen die Larven entzündetes und abgestorbenes Material (10). Die
eigentliche Wirkung wird durch proteasenreichen Speichel erzielt, den die
Maden in die Wunde absondern. Anschließend saugen sie das präoral
vorverdaute, verflüssigte Gewebe wieder auf.
Dieser Prozess ist im Gegensatz zum chirurgischen Débridement hoch
selektiv, denn gesunde Zellverbände werden kaum lysiert (11). Zusätzlich
entsteht durch die proteolytischen Enzyme ein hochgradig mikrobizides
Wundmilieu. So wird die Biochirurgie auch als heilungsfördernde Ergänzung
zur Antibiotikatherapie bei chronisch infizierten Wunden, insbesondere bei
Infekten mit Methicillin-resistenten Staphylokokken (MRSA) empfohlen (12).
Kontraindiziert ist das biologische Débridement bei starken Blutungen im
Wundbereich, in der Nähe großer Blutgefäße und in Wunden, die im Kontakt
mit Körperhöhlen und inneren Organen stehen.
Lassen sich nekrotische oder fibrinöse Beläge nicht im ersten Anlauf
beseitigen, kann ein autolytisches Débridement helfen. Auf Grund ihres
hohen Wasseranteils bewirken Hydrogele eine intensive Quellung trockener
Beläge und fördern körpereigene Wundreinigungsmechanismen, bei denen
proteolytische Enzyme freigesetzt werden. Je nach Sekretmenge kann ein
semiokklusiver Wundverband mit Hydrogel ein bis drei Tage auf der Wunde
bleiben. Beim Verbandwechsel sollten freie Gewebetrümmer ausgespült und
aufgeweichtes avitales Gewebe mechanisch entfernt werden.
Ebenfalls in der Apotheke erhältlich sind Salben und Gele mit
proteolytischen Enzymen zum enzymatischen Débridement. Dabei werden
Nekrosen angedaut sowie Koagel und Wundexsudat verflüssigt. Die
enzymatische Wundreinigung wird vielfach jedoch sehr kritisch gesehen (4,
8, 9, 14). Kein Vorteil gegenüber Placebo, häufige Verbandwechsel,
pH-Abhängigkeit, teilweise Wundheilungshemmung und Allergien, so lautet
die Kritik.
Behandlung infizierter Wunden
Chronische Wunden bleiben lange Zeit offen und sind daher immer mit
Keimen besiedelt. Doch im Allgemeinen ist die mikrobielle Kontamination
irrelevant für den Wundheilungsverlauf (13). Ausnahmen sind ischämische
Wunden bei diabetischen Fußulcera und die Kolonisation mit
multiresistenten Erregern (MRSA) bei hospitalisierten Patienten.
Auf jeden Fall müssen entzündete Wunden behandelt werden. Bei ihnen ist
der Wundheilungsprozess unterbrochen oder verzögert und es besteht die
Gefahr einer Sepsis. Außerdem gilt es, die Weiterverbreitung von
multiresistenten Erregern zu verhindern. Zu erkennen sind infizierte
Wunden an Symptomen wie Rötung, Schwellung, Fieber, Schmerzen und einem
unangenehmen Geruch. Außerdem wird vermehrt Wundflüssigkeit abgegeben.
Nach dem Débridement von nekrotischem oder verletztem Gewebe sollte
eine solche Wunde lokal antiseptisch versorgt werden (13). Dazu werden
Antiseptika wie Polihexanid, Povidon-Iod, Taurolidin oder Octenidin
eingesetzt. Auf Grund seiner guten Gewebeverträglichkeit ist Polihexanid
Mittel der Wahl bei schlecht heilenden chronischen Wunden, so die
länderübergreifende Konsensusempfehlung zur Auswahl von Wirkstoffen in der
Wundantiseptik 2004. Zu beachten ist, dass seine Wirkung erreger- und
konzentrationsabhängig vergleichsweise langsam eintritt. Das breiteste
Wirkspektrum haben Iodophore. Sie sind jedoch weit schlechter
gewebeverträglich als Polihexanid und Taurolidin, aber besser verträglich
als die Kombination Octenidin/Phenoxyethanol oder Chlorhexidin-haltige
Präparate (13).
Generell sollten Antiseptika nie länger als zwei bis sechs Tage
angewendet werden, da sie durch ihre Zytotoxizität die Wundheilung stören.
Insbesondere die Bildung von Granulationsgewebe und das Wachstum von
Epithelzellen werden behindert. Daher sind Antiseptika auch zur Prophylaxe
einer Entzündung völlig ungeeignet.
Bei einer schweren Infektion ist die systemische Gabe von Antibiotika
angezeigt. Dagegen wird die lokale Anwendung Antibiotika-haltiger Salben
und Gazen heute sehr kritisch gesehen. Sie schwächen die lokale
Immunabwehr, haben ein hohes Allergiepotenzial und fördern die Resistenz
von Bakterien.
Im EGZB sind angefeuchtete Silber-Kohle-haltige Wundauflagen Mittel der
Wahl bei einer Infektion. Im Vergleich zu anderen Antiseptika hat das
bakterizid wirkende Silber die geringste Komplikationsrate. Gleichzeitig
bindet die Aktivkohle Exsudat und damit Keime, Detritus und Geruchsstoffe
(8).
Wundmilieu soll Heilung fördern
Schon die alten Römer kannten das Prinzip der feuchten Wundauflage.
Wurden damals angebrochene Kohlblätter um die Wunde gewickelt, so stehen
heute moderne hydroaktive Materialien zur Verfügung. Das feuchte
Wundmilieu fördert die Proliferation der am Heilungsprozess beteiligten
Zellen und begünstigt deren Wanderung. So können Granulation und
Epithelisierung wesentlich schneller ablaufen.
Gleichzeitig nehmen die interaktiven Wundauflagen überflüssiges Exsudat
auf. Dabei wird nicht nur der Feuchtigkeitsgehalt der Wunde reguliert,
auch Bakterien und Zelltrümmer werden gebunden. Außerdem nimmt mit dem
Sekret die Menge schädigender Proteasen, zum Beispiel von Elastase,
Matrix-Metalloproteinase und Plasminogenaktivator, ab. Damit wird deren
Aktivität reduziert, die ansonsten in schlecht heilenden Wunden dafür
sorgt, dass sogar Wachstumsfaktoren wie der VEGF zerstört werden können
(1).
Ein konstant feuchtes Wundmilieu gewährleisten okklusive Verbände.
Dabei schließen Sekundärverbände oder mit dem Primärverband verarbeitete
Folien die Wunde bakteriendicht ab. Je nach Exsudatmenge können die
Auflagen mehrere Tage auf der Wunde belassen werden. Zu Beginn der
Therapie sollte dies nicht länger als drei Tage geschehen, während der
Granulationsphase sind auch sieben Tage möglich. Die tägliche Kontrolle
dürfe jedoch nicht vernachlässigt werden, sagte Oberarzt Fischer. Vorsicht
ist jedoch bei infizierten Wunden geboten, da das feuchte Milieu das
Wachstum von Bakterien begünstigt.
Schon die längere Tragzeit nimmt vielen Patienten die Angst vor den
bisher meist schmerzreichen Verbandwechseln. Die modernen Materialien
verkleben kaum noch mit dem neu wachsenden Gewebe und können im Gegensatz
zur Gaze nicht ausfasern, sodass keine Materialreste in der Wunde
verbleiben. Gerade in der Epithelisierungsphase werden so die
empfindlichen Epidermiszellen geschützt.
Moderne Wundauflagen
Inzwischen gibt es eine riesige Vielfalt moderner Wundauflagen. Grob
vereinfacht können sie in wenige Kategorien eingeteilt werden (Tabelle).
Tabelle: Interaktive Wundauflagen; nach (1) und (7)
Kategorie
Wirkmechanismus
Vorteile/Nachteile
Einsatz
Hydrokolloide
Bindung von Wundexsudat an
Quellsubstanzen (Gelatine, Pectin, Carboxymethylcellulose,
Superabsorber)
am häufigsten verwendet; kostengünstig;
limitierte Aufnahmekapazität, daher Mazerationsgefahr der Wundränder
mäßige bis starke Sekretion
Calcium-Alginate
Bindung von Wundexsudat an Alginate,
Gelierung durch Ca2+/Na+- Ionenaustausch
hohe Exsudatbindungskapazität;
verschiedene Darreichungsformen; anwendbar bei infizierten Wunden;
Mazerationsgefahr der Wundränder
tiefe, zerklüftete und stark
sezernierende Wunden
hydropolymere Schaumstoffverbände
kontrollierte Verdunstung von
überschüssigem Wundexsudat ohne Austrocknung des Wundbetts
hohe Exsudatkontrolle mit geringer
Massenzunahme der Auflage; Polsterung; seltenere Verbandwechsel
Granulation mit mäßig bis starker
Sekretion, für druckempfindliche Stellen geeignet
Hydrogele
Befeuchtung trockener Nekrosen und
Wunden Abbau von nekrotischen Geweben und Belägen
aktiviert und unterstützt das
körpereigene Débridement; Mazerationsgefahr der Wundränder
Nekrosen, trockene Wunden
Silber-imprägnierte Aktivkohle
bakterizid, hemmt Geruchsbildung
infizierte Wunden
Spezialitäten
Kombination verschiedener Quell- und
Grundsubstanzen
Alginate werden bei mäßig bis starker Wundsekretion vor allem in der
Reinigungsphase eingesetzt. Sie bestehen aus Salzen der Alginsäure, die
aus der Braunalge gewonnen werden, und können bis zum 20-fachen ihres
Eigengewichts an Sekret binden. Dabei entsteht ein Gel, das auch tiefe,
zerklüftete und stark sezernierende Wunden ausfüllt und ein feuchtes
Wundmilieu gewährleistet. Auch bei einer kritischen Kolonisation und
Infektion können die Kompressen oder Tamponaden angewandt werden.
Silber-haltige Wundauflagen sind vor allem bei infizierten und stark
bakteriell kontaminierten Wunden indiziert. Silber hat ein breites
antimikrobielles Wirkspektrum, aber im Gegensatz zu anderen antiseptischen
Substanzen eine sehr geringe Toxizität. Inzwischen werden verschiedene
Materialkombinationen mit Silberionen oder nanokristallinem Silber
angeboten. Es gibt Auflagen mit Silber-imprägnierten Aktivkohlefasern,
Verbände aus Hydrokolloid, Schaumstoff oder Hydrofasern mit Silberionen
und auch Calciumalginat mit nanokristallinem Silber. Manche Auflagen
müssen zur Aktivierung befeuchtet werden. Nimmt man dazu Kochsalzlösung,
kann sich Silberchlorid bilden und die bakteriziden Eigenschaften gehen
verloren (7). Das Feuchtigkeitsgleichgewicht muss sorgfältig etwa mit
sterilem Aqua destillata hergestellt werden. Sind die Auflagen zu trocken,
können sich Silberniederschläge auf der Wunde bilden.
Hydrogele haben je nach Produkt einen Wasseranteil von bis zu 60
Prozent und dienen zum Quellen von Nekrosen in der Reinigungsphase.
Außerdem werden sie zur Rehydrierung bei trockenen Wunden bis in die
Epithelisierungsphase eingesetzt. Sie sind aber auch in der Lage,
überschüssiges Wundsekret aufzunehmen. Da diese Fähigkeit begrenzt ist,
können die Wundränder leicht mazerieren (aufweichen). Hydrogele werden
daher auch kombiniert, etwa mit Hydrokolloiden oder Calciumalginat.
Hydrokolloide können größere Feuchtigkeitsmengen aufnehmen. Sie
bestehen aus Quellstoffen wie Agar oder Cellulose, die in ein hydrophobes
Polymergerüst eingebettet sind. Bei Sekretkontakt quellen die hydrophilen
Partikel zu einem Gel und haften nicht mehr auf der Wundoberfläche. Wo
keine Quellung stattfindet, klebt der Verband jedoch auf der Haut. Auch
hier besteht die Gefahr, dass die Wundränder bei zu viel Flüssigkeit
mazerieren. Die Wundumgebung sollte daher frei von Irritationen und
Ekzemen sein (7). Durch eine wasser- und bakteriendichte äußere Membran
ermöglichen Hydrokolloidverbände eine okklusive Wundbehandlung, bei der
die Feuchtigkeit besonders gut gehalten wird. Das entstehende Milieu
unterstützt die Wundreinigung und Bildung von Granulationsgewebe, da
vermehrt Fibroblasten und Makrophagen aktiviert und Wachstumsfaktoren
exprimiert werden. Hydrokolloide können bis zu einer Woche auf der Wunde
verbleiben und bis in die Epithelisierungsphase hinein verwendet werden.
Hydropolymerverbände bestehen aus nicht haftenden Materialien wie
Polyurethan-Schaumstoff in Verbindung mit einer semipermeablen
Polyurethan-Oberfläche. Sie binden Exsudat und Zelldetritus in der Matrix
und geben gleichzeitig durch Abdunsten Sekret nach außen ab. So können
größere Flüssigkeitsmengen kontrolliert werden, ohne dass das Wundbett
austrocknet. Zusätzlich wird eine Druck- und Sogwirkung auf den Wundgrund
ausgeübt, was die Granulation fördert (7). Bei mäßiger Exsudation kann der
Verband bis zu sieben Tage auf der Wunde bleiben; bei starker Exsudation
raten einige Hersteller, ihn nach einem bis vier Tagen zu wechseln.
Produkte ohne Kleberand werden auch zur Tamponade von Wundhöhlen
eingesetzt. Außerdem eignen sich die Schaumstoffe zur Polsterung
druckgefährdeter Stellen. Hydropolymerverbände sind bis in die
Epithelisierungsphase hinein anwendbar.
Hydrofaserverbände eignen sich sehr gut zum Schutz mazerierter oder
ekzematisierter Wundränder, da sie das Wundsekret nur in vertikaler, aber
nicht in horizontaler Richtung absorbieren. Die Kompressen oder Tanponaden
werden bei mittlerer bis starker Sekretion eingesetzt und lassen sich
ebenfalls bis in die Epithelisierungsphase hinein verwenden.
Folienverbände (Filmverbände) bestehen in der Regel aus Polyurethan und
werden bei leichten, oberflächlichen Wunden, als Deck- (Sekundär-) -verband
oder zum Schutz empfindlicher Hautteile, etwa bei Inkontinenz, eingesetzt.
Dank der durchsichtigen Klebefolie kann man die Wundheilung von außen gut
beobachten. Folienverbände lassen keine Bakterien passieren, sind gas- und
wasserdampfdurchlässig und können bis zu einer Woche auf der Wunde
bleiben. In der Regel kann der Patient damit auch baden und duschen.
Darüber hinaus gibt es eine Vielzahl von Materialkombinationen wie etwa
Lipidokolloide, die die Eigenschaften hydroaktiver und fetthaltiger
Verbandmaterialen miteinander vereinen, oder Hydrogele mit PVP-Iod. Auch
Techniken wie die Vakuumverbandtechnik, moderne Wundtherapeutika wie
Protease modulierende Matrix, Tissue-Engineering-Produkte oder
Wundauflagen mit Wachstumsfaktoren oder mit Metallionen und Zitronensäure
seien hier nur erwähnt.
Kein Zucker für die Wunde
Trotz der wissenschaftlichen Erkenntnisse werden immer noch veraltete
und sogar schädliche Therapien bei chronischen Wunden angewandt (6, 10).
So ist beispielsweise Haushaltszucker bei manchen Ärzten nach wie vor
beliebt. Er werde einfach in die Wunde gestreut, berichtete eine
Krankenschwester aus ihrem Pflegealltag beim Wundmanagerseminar. Zucker
soll antiseptisch wirken, die körpereigene Abwehr anregen und durch
seine osmotischen Eigenschaften die Wunde reinigen. Doch die
Komplikationsrate ist hoch. Mit dem unsterilen Zucker können Keime
eingeschleppt werden. Außerdem werden gesunde Zellen geschädigt, da das
physiologische osmotische Gleichgewicht gestört wird (8). Nachdem ein
Patient an einer Wundbehandlung mit Honig verstarb, seien Nahrungsmittel
nun per Gerichtsurteil in der Wundversorgung verboten, hieß es im EGZB.
Auch hypertone Kochsalzlösungen, Farbstofflösungen und
Wasserstoffperoxid sind als Antiseptika bei chronischen Wunden heute
überholt (8). Vor allem die toxikologischen Eigenschaften dieser Substanzen
werden kritisch diskutiert. So wirkt etwa NaCl toxisch auf Fibroblasten
und neu granulierendes Gewebe.
Außerdem werden immer noch Kompressen verwendet, die für eine feuchte
Wundversorgung ständig feucht gehalten werden müssen. Trocknen sie aus,
geht das zarte Granulationsgewebe unter. Die Patienten spüren dies durch
einen brennenden Schmerz.
Als problematisch gilt inzwischen auch Zinkpaste, die auf die
Wundränder aufgetragen wird, um die gesunde Haut bei großen Exsudatmengen
vor einer Mazeration zu schützen. Doch Zink trocknet die Haut aus und die
Salbenreste können meist nur mühsam entfernt werden. Besser geeignet sind
beispielsweise Panthenol-haltige Topika.
Sicherheit aus der Apotheke
In der modernen Therapie chronischer Wunden wird die Behandlung gezielt
an das physiologische Geschehen angepasst. Etliche konventionelle
Behandlungsmittel sind daher von neuen verträglicheren Therapeutika
abgelöst worden. Interaktive Wundauflagen verhindern eine Austrocknung des
Wundbetts, bauen nekrotisches Gewebe ab, binden Wundexsudat oder wirken
bakterizid. Chronische Wunden können so milieu- und phasengerecht
behandelt werden. Davon profitieren vor allem die Patienten. Voraussetzung
ist, dass auch die Ursachen der Wundheilungsstörung und die Grundkrankheit
behandelt werden.
Literatur und Anmerkungen
- Smola, H., et al., Wundheilung und Wundheilungsstörungen. Dt.
Ärzteblatt Nr. 43 (2001) A2802-A2407.
- Rabe, E. (Hrsg.), Leitlinien zur Diagnostik und Therapie von
Venenerkrankungen. Phlebologie 5 (2004) 30-49.
- Lobmann, R., Das diabetische Fußsyndrom. Med. Welt 56 (2005)
189-196.
- Morbach, S., et al., Diagnostik, Therapie, Verlaufskontrolle und
Prävention des diabetischen Fußsyndroms. Evidenzbasierte Leitlinie.
Diabetes und Stoffwechsel 13 (2004) 9-30.
- Smola, H., Normale Wundheilung und Problemwunden. B. Braun Melsungen
AG. www.wundheilung-online.de
- Leffmann, C., et al., Dekubitus. RKI (Hrsg.)
Gesundheitsberichterstattung des Bundes Heft 12 (2003) 22.
- Austrian Wound Association, Leitlinie zur Lokaltherapie chronischer
Wunden.
www.a-w-a.at/pdf/leitlinien_ulcus.pdf
- Braun, S., Jünger, M., Methoden des Wunddébridements bei venösem
Ulcus cruris. Phlebologie 6 (2003) 152-156.
- Standards des Wundzentrums Hamburg, Leitlinien Netzwerk Diabetischer
Fuß.
www.wundzentrum-hamburg.de
- Ziegler, U. E., Wundbettvorbereitung in der Praxis. European Wound
Management Association (EWMA) Position Document, MEP (2004) 1-17.
- Rufi, Th., Biochirurgie. Dt. Ärztebl. Nr. 30 (2002) A2038-2039.
- Ehresmann, U., et al., Diagnostik und Therapie des Ulcus cruris
venosum. Leitlinien der deutschen Gesellschaft für Phlebologie, AWMF
online, Stand 2004.
- Kramer, A., et al., Konsensusempfehlung zur Auswahl von Wirkstoffen
für die Wundantiseptik. ZfW Nr. 3 (2004) 110-120.
- Vorträge auf der Fachfortbildung Pflegeexperte Wundmanager am EGZB,
24. Jan. bis 4. Feb. 2005, Berlin.
Die Autorin
Gudrun Heyn war im
Anschluss an ihr Geologiestudium als wissenschaftliche Mitarbeiterin an
der Freien Universität Berlin tätig und untersuchte toxische Einflüsse aus
Grundwässern. Nach der Promotion arbeitete sie in verschiedenen
Forschungseinrichtungen, darunter am Kernforschungszentrum Karlsruhe und
beim Niedersächsischen Landesamt für Bodenforschung. Sie hatte
Lehraufträge an der Martin-Luther-Universität Halle-Wittenberg und der
Freien Universität Berlin. In Fachpublikationen veröffentlichte sie
Ergebnisse eigener Forschungen. Seit ihrer Ausbildung als Journalistin ist
Dr. Heyn als freie Wissenschaftsjournalistin in Berlin tätig und schreibt
für Fachzeitschriften über aktuelle Themen aus Medizin und Pharmazie.
Anschrift der Verfasserin:
Dr. Gudrun Heyn
Ferbitzer Weg 33 B
13591 Berlin
gheyn@gmx.de

© 2005 GOVI-Verlag
E-Mail: redaktion@govi.de



