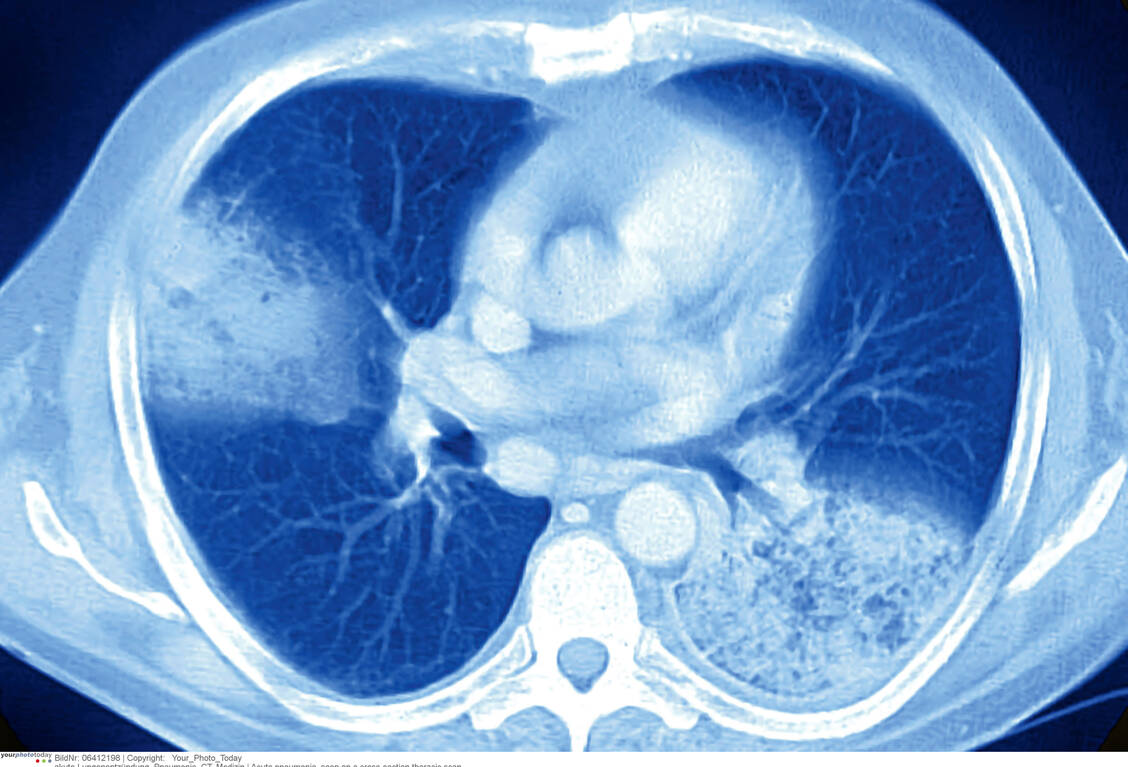
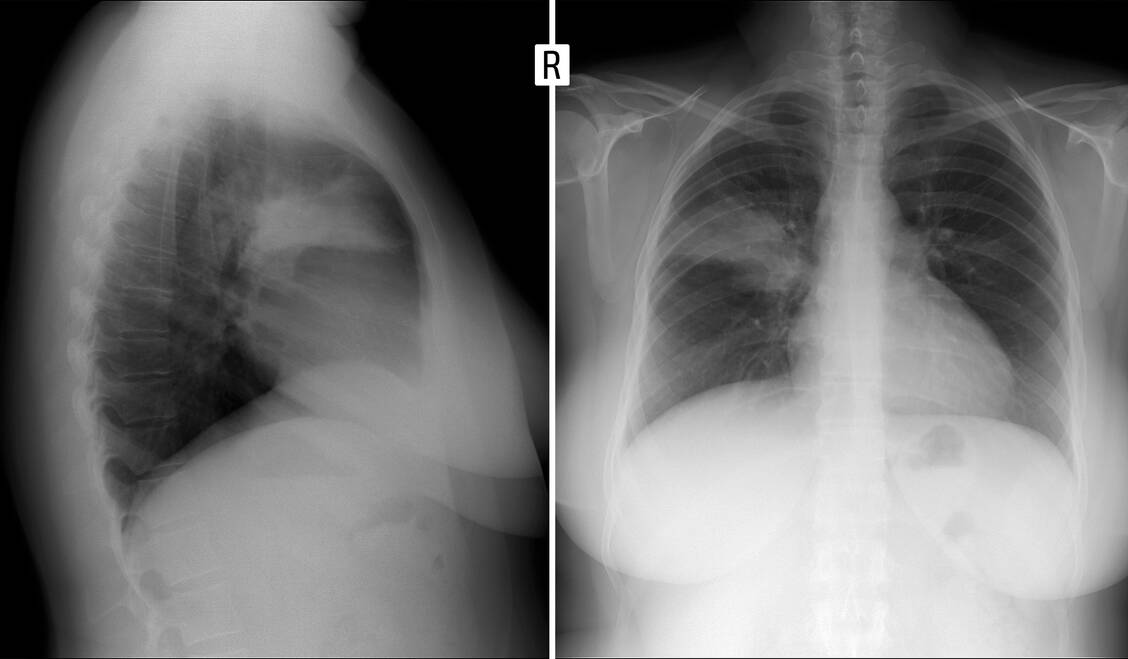
Mit dem Begriff »ambulant erworbene Pneumonie« bezeichnet man eine Lungenentzündung, die im normalen sozialen Umfeld eines immunkompetenten Patienten auftritt. Es handelt sich um eine etwas unglückliche Übersetzung der »Community Acquired Pneumonia« (CAP) des englischen Sprachraums. Sie wird unterschieden von der im Krankenhaus erworbenen, nosokomialen Pneumonie (Hospital Acquired Pneumonia; HAP) und von der Pneumonie des immungeschwächten Patienten. Für diese drei Krankheitsbilder sind sehr unterschiedliche Erregertypen verantwortlich, was Rückschlüsse auf die initiale (und hoffentlich heilende) Antibiotikatherapie zulässt.
Frühere Einteilungen nach Verschattungsmustern im Röntgenbild oder nach Erregertypen haben sich nicht bewährt.
Der häufigste Erreger einer CAP ist Streptococcus pneumoniae (»Pneumokokken«). Deutlich seltener ist Mycoplasma pneumoniae. Selten sind Chlamydia pneumoniae, Haemophilus influenzae, Staphylococcus aureus oder Legionella pneumophila zu finden. Enterokokken, zum Beispiel Escherichia coli, oder Pseudomonaden sind keine typischen Erreger einer CAP. Bei Pandemien ist an Influenza-Viren zu denken.
Auf Basis von Krankenkassendaten lässt sich vermuten, dass hierzulande jährlich mehr als 600 000 Menschen an einer CAP erkranken. Etwa die Hälfte davon wird im Krankenhaus behandelt, vorwiegend ältere Menschen. Die schwereren Verläufe sind immer noch mit einer hohen Letalität (etwa 13 Prozent) belastet; ein Drittel dieser Patienten stirbt schon innerhalb der ersten drei Tage (2). Die Ursachen dafür sind septische Verläufe, das heißt zu späte Diagnosestellung oder Verzögerung der Antibiotikagabe, sowie Komorbiditäten, das heißt chronische Vorerkrankungen, die sich unter der Pneumonie verschlimmern. Dekompensierte Komorbiditäten, zum Beispiel Herz-Kreislauf-Erkrankungen, Leber- oder Niereninsuffizienz oder neurologische Erkrankungen, können auch zum Tod älterer Menschen nach der Entlassung aus dem Krankenhaus beitragen.
Die medizinische Situation ist also unbefriedigend. Es ist nötig, Risikopatienten schneller und zuverlässiger zu identifizieren, um möglichst umgehend mit einer kalkulierten Antibiotikatherapie beginnen zu können. Hier zählen tatsächlich Stunden. Ebenso wichtig ist es, die Verschlimmerung von Begleiterkrankungen sofort zu erkennen und mitzubehandeln. Im Update der S3-Leitlinie »Behandlung von erwachsenen Patienten mit ambulant erworbener Pneumonie und Prävention« wird das berücksichtigt (3).