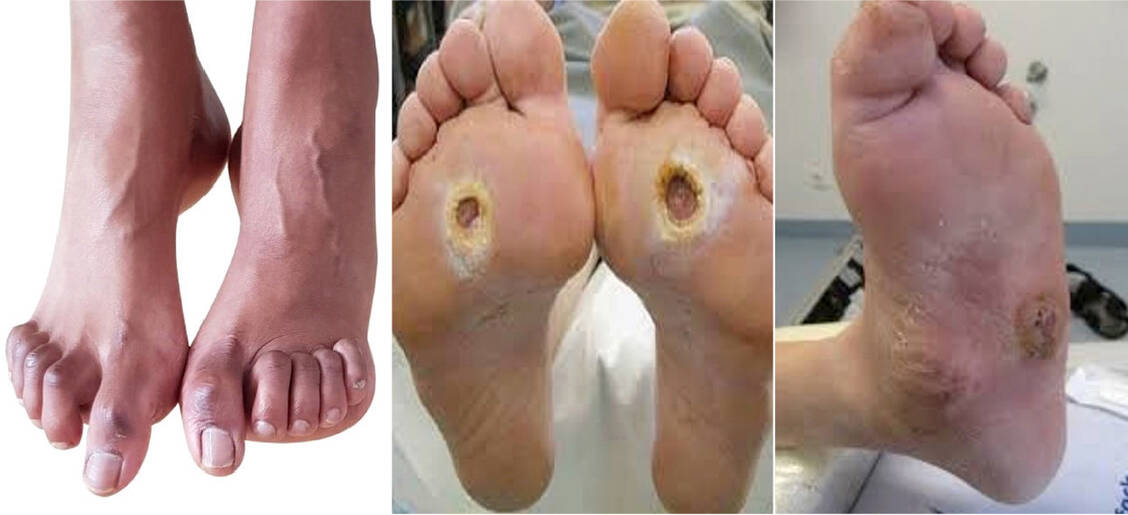
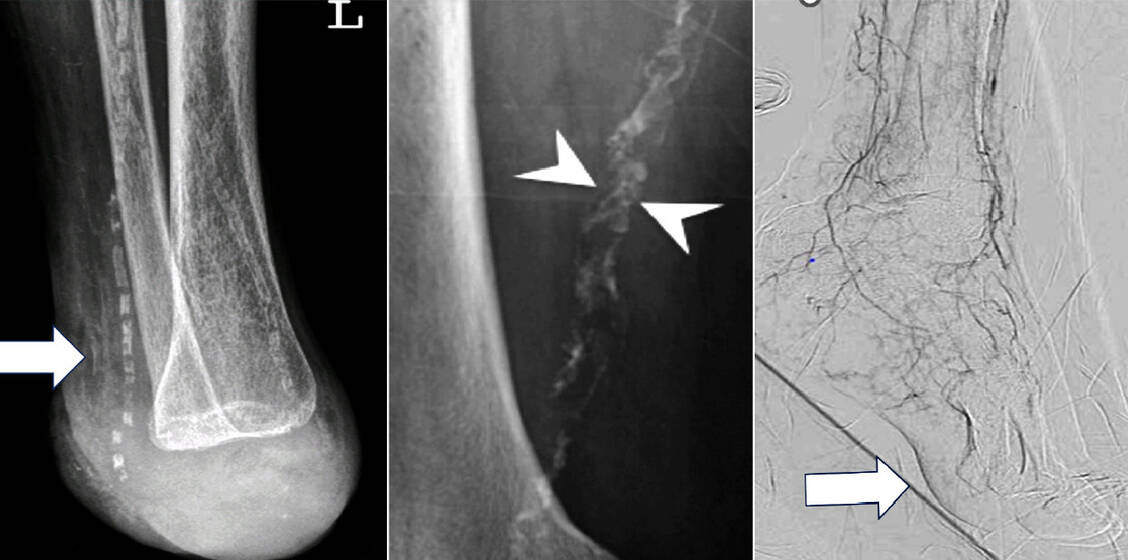
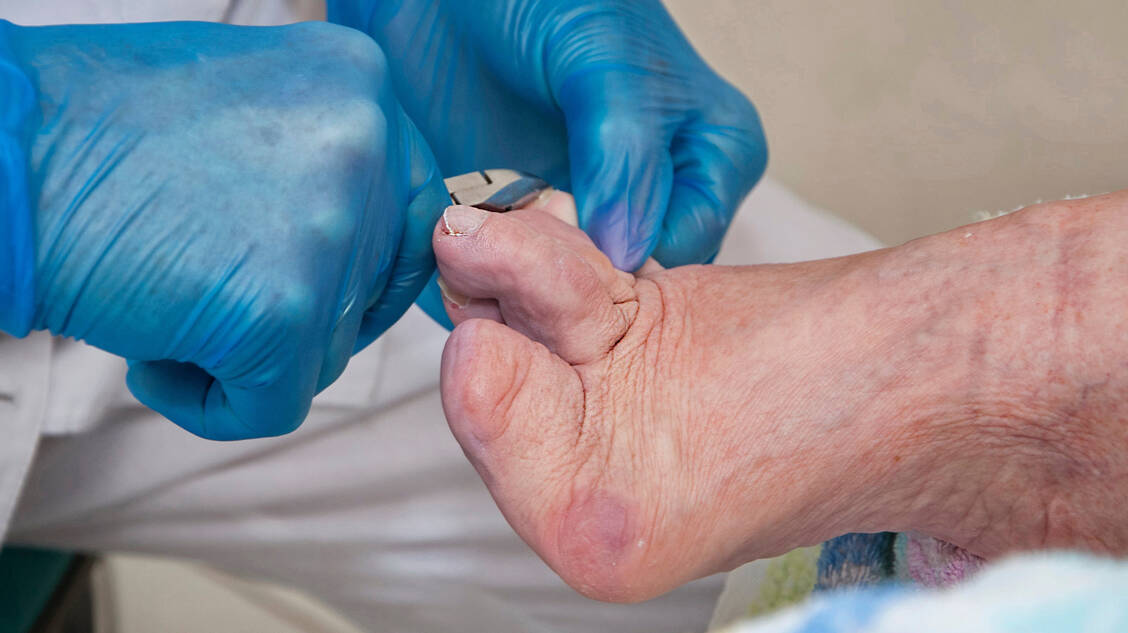
Hilfreich ist deshalb, Menschen mit Diabetes mellitus in der Apotheke auf Risikofaktoren und Prävention anzusprechen. Wichtige Themen sind die Qualität der Stoffwechseleinstellung, mögliche krankhafte Fußveränderungen, eine Polyneuropathie oder pAVK, frühere Fußprobleme, Fußläsionen oder Amputation sowie die Frequenz von Eigenuntersuchungen und fachärztlichen Fußuntersuchungen. Ebenfalls anzusprechen sind das Tragen von geeignetem Schuhwerk und die Möglichkeit podologischer Komplexbehandlungen.
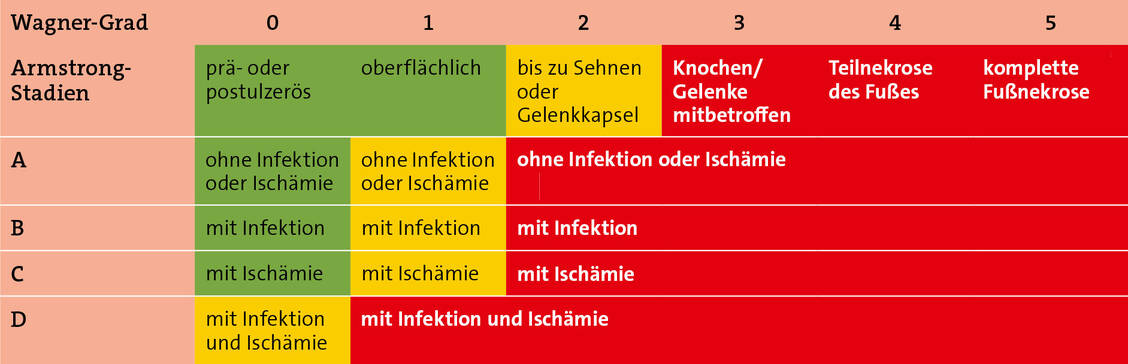
Die allgemeine Präventionsstrategie des DFS umfasst neben der Selbstinspektion und der regelmäßigen fachärztlichen Untersuchung, deren Frequenz sich nach der Risikoklassifikation richtet (Tabelle 1), auch die gezielte Schulung sowie allgemeine und spezielle Maßnahmen.