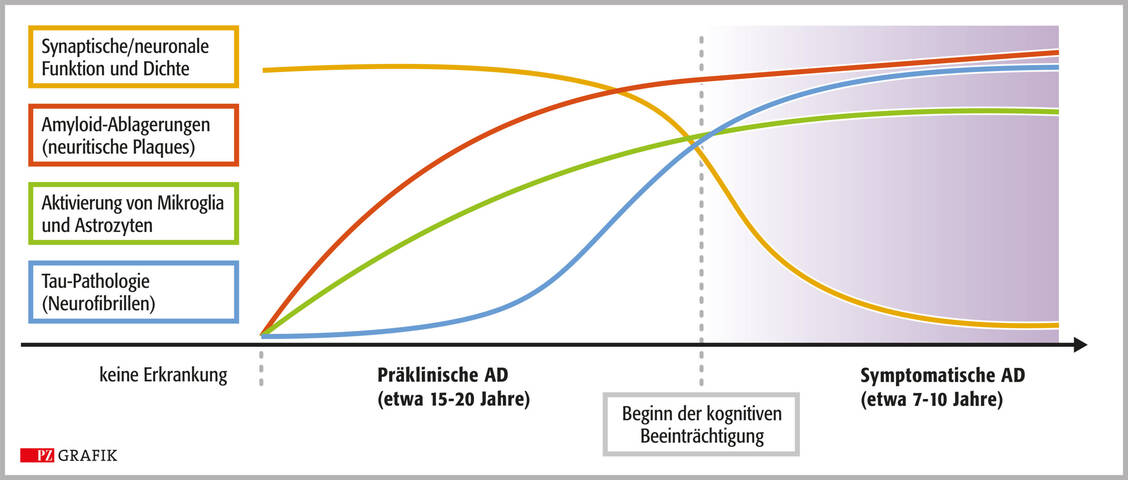
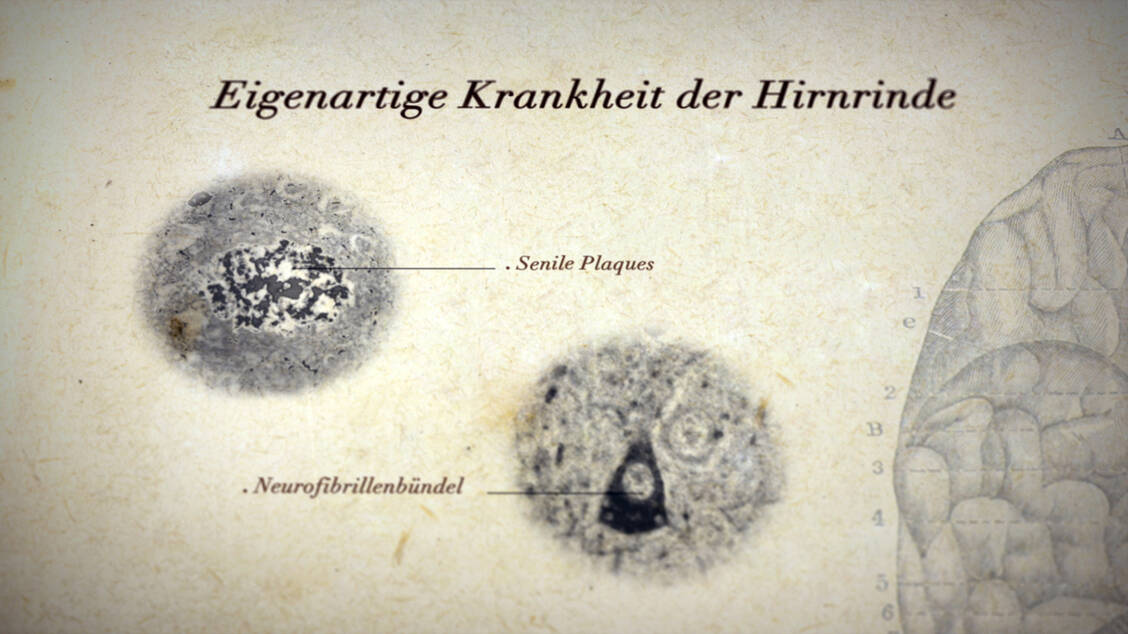
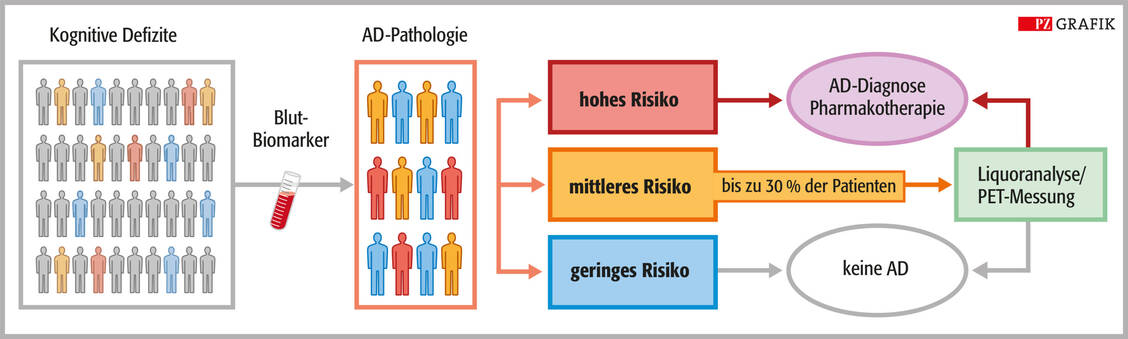
Carsten Culmsee studierte Pharmazie in Marburg und wurde dort 1997 am Institut für Pharmakologie und Toxikologie promoviert. Nach einem Postdoc-Aufenthalt mit DFG-Stipendium am Sanders Brown Research Center on Aging an der University of Kentucky, Lexington, USA, einer Tätigkeit als Gruppenleiter und Dozent an der Universität Marburg (2000 bis 2003) und am Zentrum für Arzneimittelforschung der Universität München (bis 2007) kehrte er 2007 als Professor für Klinische Pharmazie an die Universität Marburg zurück. Zudem ist er Prodekan des Fachbereichs Pharmazie.
Jana Fedjaev studierte Pharmazie an der Universität Münster. Nach einem Forschungsaufenthalt an der University of British Columbia in Vancouver, Kanada, begann sie 2024 ihre Promotion in der Arbeitsgruppe von Professor Culmsee am Institut für Pharmakologie und Klinische Pharmazie der Philipps-Universität Marburg. Zudem ist sie als Apothekerin in der Apotheke am Ludwigsplatz in Gießen tätig.
Hanna Rosemarie Hofmann studierte von 2019 bis 2024 Pharmazie an der Philipps-Universität Marburg und schließt das Studium im Oktober 2024 mit dem 2. Staatsexamen ab. Im Wahlpflichtfach »Klinische Pharmazie« erstellte sie einen Essay zum Thema »Amyloid-Beta bei Alzheimer-Erkrankung und Impfstoffe gegen Alzheimer«.
Johanna Lücke studierte von 2019 bis 2024 Pharmazie an der Philipps-Universität Marburg und war von 2023 bis 2024 auch als studentische Hilfskraft tätig. Im Oktober 2024 schließt sie das Studium mit dem 2. Staatsexamen ab. Im Wahlpflichtfach »Klinische Pharmazie« erstellte sie einen Essay zum Thema »Neue Behandlungsansätze für Tauopathien bei Morbus Alzheimer«.