Die bisherige Pharmakotherapie der hypertrophen obstruktiven Kardiomyopathie (HOCM) zielte auf Symptomlinderung ab. Nun gibt es dank Mavacamten erstmals einen zugelassenen Arzneistoff, der mit kausalem Ansatz zielgerichtet in das Krankheitsgeschehen eingreift. Allein dies reicht schon für die Einstufung als Sprunginnovation.
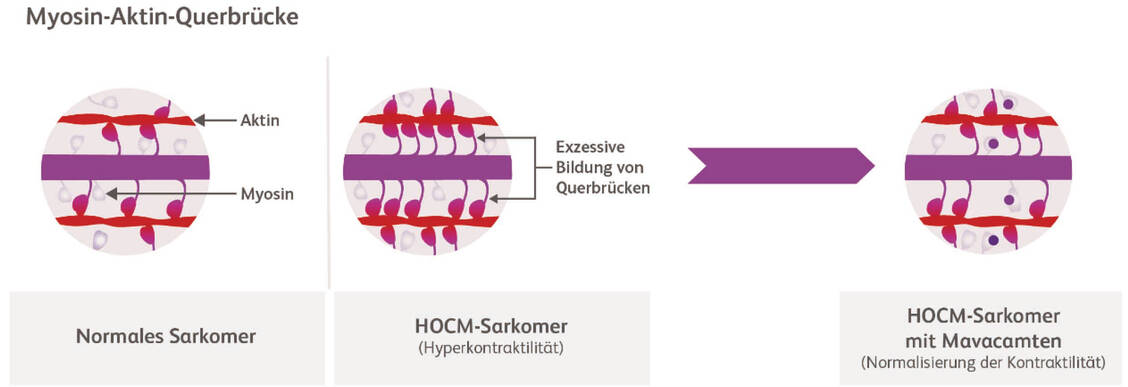
Hinzu kommt, dass Mavacamten ein First-in-Class-Wirkstoff ist. Aficamten könnte eines Tages der zweite Vertreter dieser Gruppe werden. Bis dato ist aber Mavacamten hierzulande der einzige kardiale Myosin-Inhibitor. Als solcher reduziert er die Ausbildung von Aktin-Myosin-Querbrücken am Herzen und damit die Obstruktion in der linken Herzkammer. So wird der Füllungsdruck während der Diastole gesteigert.
Auch die Ergebnisse der Zulassungsstudien untermauern den hohen Innovationsgrad von Mavacamten. Sie zeigen, dass der Wirkstoff bei HOCM die körperliche Leistungsfähigkeit steigern, die Obstruktion im linksventrikulären Ausflusstrakt verringern und Symptome sowie Gesundheitsstatus der Betroffenen klinisch relevant verbessern kann. Besonders hervorzuheben ist, dass die Notwendigkeit für eine invasive Septumreduktionstherapie mit Mavacamten in der VALOR-HCM-Studie deutlich vermindert werden konnte.
Mit Spannung darf man auf die Resultate von Langzeitstudien warten. Hier stellt sich zum Beispiel die Frage, inwiefern mit einer Erhöhung der Lebenserwartung durch Mavacamten zu rechnen ist. Die Zukunft wird ferner zeigen, ob sich der Arzneistoff auch in anderen Indikationen bewährt. Getestet wird er klinisch zum Beispiel bei nicht obstruktiver Kardiomyopathie sowie bei bestimmten Formen der Herzinsuffizienz.
Last, but not least sei darauf hingewiesen, dass vor Therapiestart mit Mavacamten der CYP2C19-Genotyp des Patienten bestimmt werden muss, um die richtige Dosierung festsetzen zu können. Die Fachinformation schreibt vor, was gegebenenfalls bei gleichzeitiger Behandlung mit CYP2C19- oder CYP3A4-Inhibitoren oder -Induktoren zu tun ist. Dies ist sicher auch für Apotheker bei der Abgabe von Mavacamten gut zu wissen.
Sven Siebenand, Chefredakteur